|
|
Главная
/
Медицинские публикации
/
Авторы
/
Песков Д. Л., ООО НПФ "Лабораторная техника"
/
ЭЛЕКТРОФОРЕЗ СЫВОРОТОЧНЫХ БЕЛКОВ: СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ АНАЛИЗА
Гильманов А.Ж., д.м.н., профессор
Саляхова Р.М., к.м.н., доцент
Кафедра лабораторной диагностики ИПО Башкирского медуниверситета, г. Уфа
Информативность и экономичность – важнейшие требования к лабораторным исследованиям, которые приходится учитывать как в отечественной, так и в зарубежной практике. Одним из достаточно информативных лабораторных тестов, используемых в настоящее время, является электрофорез белков биологических жидкостей (сыворотка крови, моча, спинномозговая жидкость и др.), который позволяет получить значительную диагностическую информацию. К сожалению, в большинстве лабораторий нет необходимых приборов. В то же время часть лабораторий, имеющих оборудование для электрофореза, им зачастую не пользуется из-за поломок, отсутствия расходных материалов или, как нередко бывает, невостребованности этого типа анализов лечащими врачами вследствие их недостаточной осведомленности о современных возможностях и клинической значимости этого метода. Исследование белкового и липопротеинового спектра сыворотки крови особенно значимо для диагностики патологических состояний, сопровождающихся нарушениями обмена белков и дислипопротеидемиями. При многих заболеваниях в сыворотке крови изменяется соотношение отдельных белков (диспротеинемия), хотя общее содержание белка может остаться нормальным.
В настоящее время известно более 150 индивидуальных сывороточных белков; значительную часть из них можно количественно определить современными иммуноферментными, иммунохемилюминесцентными и иммунотурбидиметрическими методами. Но при всей информативности и доказательности таких анализов пока они в основном малодоступны из-за сравнительной дороговизны: себестоимость одного количественного определения апопротеинов, антитрипсина или иммуноглобулинов составляет от 2 до 8 долларов США. Вместе с тем типовые сдвиги белкового состава сыворотки крови можно определить гораздо более доступным электрофоретическим методом, который к тому же позволяет «одним взглядом» оценить общую картину белкового спектра и получить значимую диагностическую информацию.
Принцип электрофоретического разделения молекул состоит в их движении с различной скоростью в постоянном электрическом поле. Наиболее часто в клинической практике используется электрофорез на поддерживающих средах-носителях – хроматографической бумаге, ацетатцеллюлозных мембранах, различных гелях, а также на комбинированных средах. Электрофорез на бумаге до недавнего времени широко применялся во многих лабораториях, однако он имеет много недостатков. Основной из них – в том, что результаты фракционирования белков этим методом могут быть получены лишь на 2-3 день исследования. Электрофорез в агарозном, крахмальном и особенно в полиакриламидном геле дает существенно лучшие результаты, позволяя идентифицировать большее количество белковых фракций сыворотки (до 30), но и ему присущи недостатки – сложность приготовления геля или дороговизна готовых гелевых пластин. Использование мембран из ацетата целлюлозы позволяет достигнуть компромисса и использовать их главные особенности - однородность материала, очень малую емкость слоя, требующую микроколичеств пробы (0,4–2,0 мкл), быстроту разделения и окраски белков (20-80 мин), легкость отмывания фона, а также относительно низкую стоимость пленок и их доступность. В целом применение ацетатцеллюлозных мембран позволяет повысить четкость фракционирования и значительно сократить время, требуемое для разделения, окраски и анализа.
Знак и величина электрического заряда молекул белков сыворотки крови, а значит, направление и скорость их движения при электрофоретическом разделении, зависят от значения рН и ионной силы среды. Кроме того, скорость движения белковых молекул определяется их молекулярной массой, ионным окружением (составом и концентрацией буфера), приложенным напряжением и другими факторами. В связи с этим для получения сопоставимых данных электрофорез должен осуществляться при строго определенных значениях указанных параметров. В буферном растворе с рН=8,6 или 8,9 и ионной силой 0,08–0,15 моль/л все белки сыворотки крови приобретают отрицательный заряд и движутся от катода к аноду, причем дальше всего уходят альбумины, имеющие меньшую молекулярную массу, затем располагаются a1-, a2-, b- и g-глобулины. Иногда каждая из этих основных фракций может разделиться на несколько подфракций.
Следует указать, что результаты электрофореза сильно зависят от подготовки пробы и мастерства лабораторного персонала. Сыворотку крови для исследования лучше брать свежей, хранившейся не более нескольких часов. В пробе не должно быть следов гемолиза; в противном случае свободный гемоглобин и его комплекс с гаптоглобином могут образовать дополнительные полосы в области a2- и b-глобулинов. В присутствии ионов кальция и под влиянием некоторых лекарственных веществ возможно расслоение b-фракции на две подфракции, что объясняется нарушением подвижности С3-компонента комплемента. Наконец, в целом качество «картинки» зависит от навыков нанесения пробы (это тоже определенное искусство, формирующееся практикой) и используемых инструментов-аппликаторов.
Необходим постоянный контроль рН буфера, применяемого для электродных камер и для смачивания пленок, т.к. от его значения зависит качество разделения фракций. Дело в том, что в ходе электрофореза на аноде и катоде протекают различные электрохимические процессы, приводящие к изменениям характеристик буферных растворов (в частности, рН). В связи с этим для восстановления его значения некоторые специалисты рекомендуют по окончании рабочего дня смешивать буферные растворы из разных электродных камер путем сливания в один сосуд, что позволяет существенно продлить срок службы буфера (в зависимости от интенсивности работы - до нескольких недель и более, но с условием периодического контроля рН; при выходе этого показателя за пределы ±0,1‑0,2 от требуемых величин буферный раствор подлежит замене на свежеприготовленный). Срок работы электродных буферных растворов уточняется опытным путем; обычный признак потери их годности – сокращение длины разгонной дорожки, «наложение» белковых фракций друг на друга и «обрезанный» задний край гамма-глобулиновой фракции при обычных значениях тока (напряжения) и времени электрофореза. Замачивание пленок необходимо всегда осуществлять в свежем буферном растворе, не применявшемся в качестве электродного буфера.
Надо помнить, что электрофорез относится к полуколичественным исследованиям. Это определяется самой «технологией» его этапов, в частности, окраски проб и денситометрии. По принятым международным правилам, первоначальная оценка результатов электрофоретического разделения сывороточных белков (выявление нормы или патологии) должна проводиться визуально, путем сравнения с картиной нормальной сыворотки, а количественные данные предназначены только для документирования результатов и динамического наблюдения. При оценке фракций только по процентному их содержанию возможны ошибки трактовки анализа. Например, при гипергаммаглобулинемии относительное количество альбумина (в %) автоматически окажется сниженным, хотя его абсолютная концентрация (в г/л) реально не изменялась. Для исключения недоразумений желательно количественно определять белковые фракции - в г/л, что легко осуществить умножением процентного содержания отдельных фракций на концентрацию общего белка в сыворотке крови. Можно дополнительно провести определение уровня сывороточного альбумина колориметрическим методом и результат сравнить со значением, полученным при электрофорезе; эта процедура одновременно поможет оценить качество анализа.
С учетом приведенного выше, при интерпретации результатов клиницистам нет смысла придавать диагностическое значение, например, снижению содержания альбумина у пациента на 2-3% от справочных данных. Само понятие нормы в лабораторной практике весьма условно; нормальные значения параметров зависят от местных факторов и должны формироваться в первую очередь «на местной базе», т.е. в конкретной лаборатории при обследовании здорового контингента. Вместе с тем для общего контроля качества разделения белков выпускаются специальные контрольные сыворотки, которые желательно иметь в каждой лаборатории, работающей этим методом.
Приведенные положения о количественной оценке фракций в полной мере относятся и к электрофоретическому разделению липопротеинов сыворотки крови, применяемому для оценки типа и тяжести гиперлипопротеинемии (ГЛП) с учетом количества триглицеридов, холестерина общего и холестерина в составе ЛПВП. Наибольшее значение электрофоретический метод имеет для дифференциальной диагностики атерогенной ГЛП III типа и умеренно атерогенной ГЛП V типа: ГЛП-III характеризуется наличием патологически измененных (аномальных) ЛП, отличающихся значительным содержанием ТГ, ХС и одновременно высокой электрофоретической подвижностью; на графике будет видно слияние фракций ЛПНП и ЛПОНП (b-ЛП и пре-b-ЛП). Но надо помнить, что методом электрофореза выявляется только относительное распределение фракций, количественная оценка отдельных ЛП не рекомендуется, поскольку для этого метода не существует стандартных калибровочных и контрольных материалов.
Для электрофореза белков используются различные аппараты, как ручные, так и полуавтоматические. Современные комплексы оснащены микропроцессорными блоками питания и управляются компьютером; в большинстве систем на последней стадии исследования окрашенных мембран или гелевых пластинок (определения относительного количества белков в каждой фракции) используется электронный цветной сканер или миниатюрная фотокамера, что существенно повышает точность и воспроизводимость результатов. Программное обеспечение дает возможность усредненного расчета оптической плотности отдельных фракций путем автоматического определения границ «дорожек» и многократного сканирования каждой из них в нескольких «разрезах», что позволяет исключить ошибки из-за локальных микродефектов и неровного положения носителя, а также до определенной степени нивелировать искривление дорожки и влияние окрашенного фона при неполной отмывке. На экран дисплея и на принтер выводится график-денситограмма с рассчитанным содержанием отдельных белковых фракций. При необходимости маркеры границ фракций на графике можно скорректировать, при этом будет произведен автоматический пересчет их показателей. В компьютере, как правило, создается архив электрофореграмм; их можно в любое время извлечь и просмотреть.
Электрофорез белков, позволяющий определить их количественные сдвиги и физико-химические характеристики, помогает выявить заболевания печени и почек, иммунной системы, некоторые злокачественные новообразования (лейкозы), острые и хронические инфекции, генетические поломки и др. Известен ряд своеобразных электрофоретических "синдромов" – типичных картин электрофореграмм, характерных для некоторых патологических состояний. Среди них можно отметить:
1. Острое воспаление с активацией системы комплемента и увеличением синтеза острофазных белков (a1-антитрипсина, гаптоглобина, фибриногена и др.). Оно проявляется увеличением доли a1- и a2-глобулинов и может быть подтверждено измерением СОЭ, исследованием концентрации С-реактивного белка, фибриногена (в динамике) и других острофазных белков.
2. Хроническое воспаление с усилением синтеза ряда острофазных белков, а также иммуноглобулинов; проявляется умеренным возрастанием a2- и b-глобулинов, повышением g-глобулинов и некоторым снижением альбумина. Подобные отклонения могут наблюдаться при хронических инфекциях, коллагенозах, аллергии, аутоиммунных процессах и при малигнизации.
3. Тяжелые заболевания печени сопровождаются снижением синтеза альбумина и a‑глобулинов, что и отражается на электрофореграммах. Как указывалось выше, нужно помнить, что процентная концентрация альбумина может оказаться сниженной лишь относительно, из-за накопления других белков, поэтому оценивать нарушения белково-синтезирующей функции печени следует по абсолютному содержанию альбумина (в г/л). При хронических гепатитах и циррозах печени возрастает как относительное, так и абсолютное количество g-глобулинов (b- и g-фракции могут сливаться из-за накопления IgA), причем превышение g-глобулинов над альбуминами является весьма неблагоприятным прогностическим признаком.
4. Нефротический синдром сопровождается увеличением фильтрации белков в почках и селективной протеинурией – потерей с мочой большого количества альбумина и части низкомолекулярных глобулинов (a1-антитрипсина, трансферрина). При этом в печени усиливается синтез более крупных протеинов семейства a2-глобулинов (макроглобулин, апо-В), которые накапливаются в крови и формируют картину со значительным снижением альбумина и повышением a2-глобулинов.
5. Нарушение всасывания или значительная потеря белков возможна как при нефротическом синдроме, так и при массивных ожогах, синдроме Лаэлла, патологии желудочно-кишечного тракта и т.д. В последнем случае снижается абсолютное содержание общего белка и особенно альбумина, а на протеинограмме оказывается уменьшенной доля альбумина при относительно равномерном возрастании всех глобулинов. Введение белковых препаратов (иммуноглобулины, альбумин или плазма крови) в ходе лечения больных немедленно отражается на электрофоретической картине, что позволяет следить за динамикой потерь или выведения поступивших белков.
6. Тяжелый иммунодефицит врожденного или приобретенного генеза обычно сопровождается выраженным снижением g-глобулиновой фракции. При этом желательно провести дополнительное количественное определение IgG, IgA и IgM.
7. Парапротеинемия при злокачественных и доброкачественных процессах – симптом, для выявления которого именно электрофорез является методом выбора. При накоплении в крови моноклональных иммуноглобулинов или фрагментов их цепей, как бывает, в частности, при миеломной болезни и некоторых лейкозах, на протеинограмме появляется более или менее острый пик в области от a2- до g-глобулинов (так называемый М‑градиент), хорошо заметный визуально. Электрофорез белков мочи, проведенный параллельно, в этом случае выявит пик, находящийся в той же области. Для дифференцировки парапротеинов и идентификации белковых цепей можно использовать современнейшую модификацию электрофореза – иммунофиксацию, для которой выпускаются специальные гелевые пластины с антисыворотками.
Ниже представлены примеры интерпретации данных исследования сыворотки крови нескольких пациентов, проведенного с помощью устройства электрофореза с анализатором электрофореграмм УЭФ-01-«Астра» производства НПЦ «Астра» (г. Уфа).
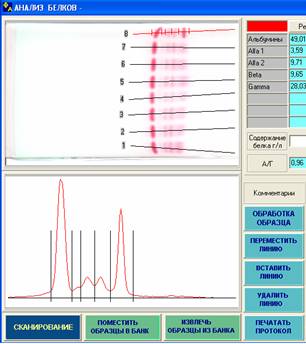
Рис. 1. На протеинограммах хорошо виден М-градиент в области g‑глобулинов, что свидетельствует о гаммапатии (скорее всего моноклональной), сопровождающейся резким повышением g-глобулиновой фракции, снижением b‑глобулинов и альбуминов. Это может быть характерно для g-плазмоцитом, макроглобулинемии Вальденстрема, амилоидоза, лимфомы, а также возможно при введении некоторых антикоагулянтов. Для уточнения диагноза необходимо определение содержания общего белка в сыворотке крови и белка Бенс-Джонса в моче, проведение электрофореза с иммунофиксацией и др.
Рис. 2. Изменения на представленных электрофореграммах также характерны для моноклональной гаммапатии. Резко повышена g-глобулиновая фракция (хорошо заметен М-градиент).
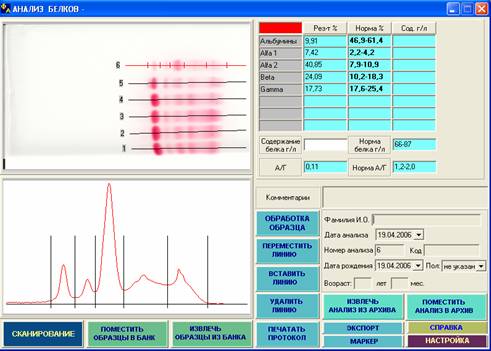
Рис. 3. На протеинограмме - значительное снижение альбуминов, резкое повышение a2-глобулинов и некоторое
возрастание b‑глобулинов. Значительное уменьшение уровня как альбуминов, так и общего белка в сыворотке крови характерно для нефротического синдрома; косвенным свидетельством гипопротеинемии может быть низкая интенсивность окраски белковых фракций данной дорожки по сравнению с соседними. Другие, более редкие состояния со сходным изменением фракций: a2-плазмоцитома, опухоли, термические ожоги, ряд острых и подострых заболеваний, а также анальбуминемия. Для уточнения диагноза необходимо определение общего белка в сыворотке крови, электрофорез с иммунофиксацией, электрофорез белков мочи и т.д.
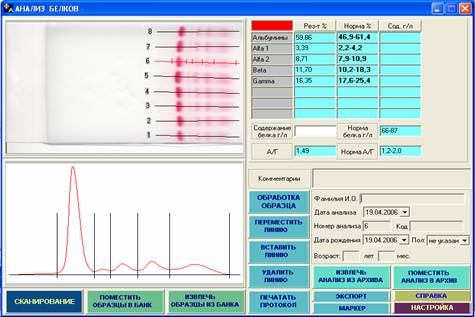
Рис. 4. Отмечается небольшое избирательное снижение фракции g‑глобулинов, что возможно при иммунодефиците, иммуносупрессии на фоне лечения кортикостероидами, иммунодепрессантами, химиотерапии, а также при некоторых лимфопролиферативных заболеваниях.
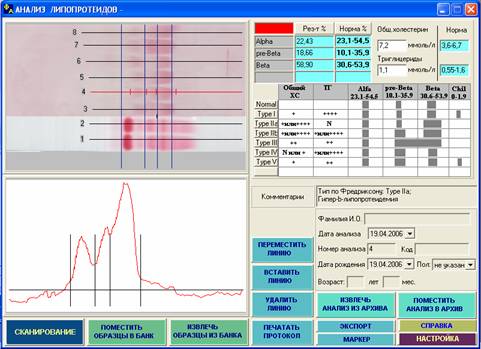
Рис.5. На данной электрофореграмме представлены результаты разделения липопротеидов сыворотки крови, выполненного параллельно с сывороточными белками. Отмечается увеличение фракции пре-b-липопротеинов, что в сочетании с повышением уровня общего холестерина и триглицеридов и равномерно-мутным видом сыворотки характерно для ГЛП IV типа. Для окончательного фенотипирования необходимы данные о клинических проявлениях заболевания, наследственной отягощенности и индексе атерогенности.
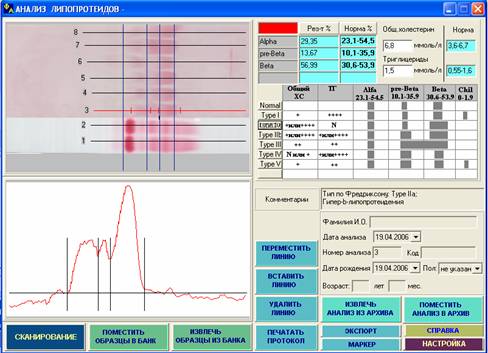
Рис. 6. Данная фореграмма отражает увеличение фракции b-липопротеинов на фоне повышения содержания общего холестерина (6,8 ммоль/л) и нормального уровня триглицеридов (1,1 ммоль/л), что при прозрачной сыворотке характерно для ГЛП IIа типа.
Рис. 7. Данная фореграмма также свидетельствует о ГЛП IIа типа (увеличение фракции b-липипротеинов, повышение содержания холестерина (7,2 ммоль/л), нормальный уровень триглицеридов (1,5 ммоль/л). Сыворотка у таких больных прозрачная.
Электрофоретические методы в клинической лабораторной диагностике имеют хорошую перспективу. Так, среди новинок можно отметить автоматические системы капиллярного электрофореза, которые выполняют быстрое разделение биомолекул внутри капилляра под действием высокого напряжения; для таких приборов требуются уже не микролитры, а нанолитры образца. В целом использование современных электрофоретических анализаторов позволяет с высокой точностью и минимальными затратами исследовать широчайший спектр биохимических параметров с целью уточнения диагноза, мониторинга патологического процесса и обоснования методов терапии заболеваний.
ЛИТЕРАТУРА
1. Сергеева Н.А. // Клин. лаб. диагн. – 1999. - № 2. - С. 25-32.
2. Титов В.Н., Амелюшкина В.А. Электрофорез белков сыворотки крови. –М., 1994.
3. Камышников В.С. Справочник по клинико-биохимической лабораторной диагностике (в 2-х томах). Минск, 2000. -463 С.
|