❶Главная
/
❷Медицинские публикации
/
❸Ветеринария
/
Генотипування мікобактерій за допомогою гель-електрофорезу в пульсуючому полі
УДК 619:579:577.2
Генотипування мікобактерій за допомогою гель-електрофорезу в пульсуючому полі
Cкрипник А. В., канд. вет. наук, с.н.с.1,
Стегній Б. Т., д-р. вет. наук, проф., акад. УААН1,
Завгородній А. І., д-р. вет. наук, проф., чл.-кор. УААН1
1 Національний науковий центр «Інститут експериментальної і клінічної ветеринарної медицини», м. Харків
Скрипник В. Г., д-р. вет. наук, с.н.с. 2
2 Державний науково-контрольний інститут біотехнології і штамів мікроорганізмів, м. Київ
Мозер І., д-р. вет. наук3
3 Інститут ім. Фрідріха Льофлера, м. Йєна, Німеччина
У статті викладено теоретичні основи методу гель-електрофорезу в пульсуючому полі і результати фінгерпринтинга 23 штамів мікобактерій, ізольованих у різних регіонах України. Сконструйована на основі поліморфізму патернів дендрограма продемонструвала високу ступінь гетерогенності штамів Mycobacterium fortuitum, які було розподілено на дві групи в залежності від регіону. Підтверджено дані про циркуляцію на території України Mycobacterium engbackii і Mycobacterium parascrofulaceum. Показано можливість використання гель-електрофорезу в пульсуючому полі для встановлення ступеня генетичної спорідненості широкого спектра видів мікобактерій.
Туберкульоз є однією з найбільших загроз людству. В Україні це зооантропонозне захворювання також залишається надзвичайно гострою і актуальною проблемою як для гуманної, так і для ветеринарної медицини. Незважаючи на значні досягнення ветеринарної служби, захворювання тварин на туберкульоз реєструється в ряді регіонів і завдає значних збитків тваринництву України [1].
На сьогоднішній день діагностика туберкульозу в Україні проводиться із застосуванням комплексу епізоотологічних, алергічних, патологоанатомічних і бактеріологічних методів.
Розвиток новітніх технологій на рівні ДНК, зокрема застосування гель-електрофорезу в пульсуючому полі (ГЕПП), відкриває нові можливості щодо проведення типування штамів, тобто визначення ступеня їх генетичної спорідненості. Метод ГЕПП ґрунтується на генерації штамо-специфічних патернів ДНК (фінгерпринтингу). При цьому поліморфізм фінгерпринтних патернів ДНК між неспорідненими клінічними ізолятами є дуже високим у той час, коли епізоотично споріднені штами показують ідентичні або дуже схожі патерни фінгерпринтингу [9].
Висока розподільна здатність ГЕПП дозволяє проводити високоінформативний аналіз міжштамової спорідненості, що широко застосовується в епідеміологічних і епізоотологічних дослідженнях як швидко, так і повільно зростаючих мікобактерій [3, 4, 5].
ГЕПП дає змогу дослідити геном бактерії в цілому, що є вагомою перевагою над іншими молекулярними методами, при використанні яких до уваги дослідника потрапляє лише один ген (або його частина), що складається в більшості випадків менш, ніж з 1 000 п. н., в той час, коли геном мікобактерій налічує близько 4 – 5 мільйонів п. н. Проблеми з типуванням і диференціацією виникають через те, що спорідненість мікобактерій, якщо брати за критерій аналізу один ген, може бути більшою, а інший ген – меншою [8].
Для впровадження цього методу застосували комбінацію новітніх методик: екстракції інтактної хромосомної ДНК в агарозних блоках та електрофорез із використанням перемінного електричного поля. Цей метод став справжнім проривом у дослідженні геному про- та еукаріотів [10].
Принцип методу полягає в застосуванні одного чи двох електричних полів для генерації імпульсів під різними кутами (гексагональна орієнтація електродів), що дозволяє реорієнтацію великих молекул ДНК у матриці агарозного гелю та надає можливість сепарації фрагментів ДНК величиною до 10 мільйонів п. н. В альтеруючому електричному полі фрагмент ДНК буде мігрувати в одному напрямку, а після зміни електричного поля – в іншому. Такими короткими рухами, які залежать від часу електричних імпульсів, ДНК буде мігрувати вперед [2].
На відміну від цього звичайний електрофорез у гомогенному односпрямованому електричному полі дозволяє сепарацію фрагментів ДНК не більших, ніж 50 тисяч п. н.
Для проведення ГЕПП хромосоми піддають обробці рестрикційними ензимами, що дозволяє проводити ідентифікацію внутрішніх сайтів рестрикції і композицію фрагментів. Одним із найчастіше використовуваних ензимів для молекулярного аналізу мікобактерій є рестрикційна ендонуклеаза XbaI, яка розрізає ДНК у сайті розпізнавання Т / СТАGA [10].
Отримані в результаті профілі рестрикції візуалізують шляхом фарбування агарозного гелю бромідом етидія і аналізують за допомогою широкого спектра комп’ютерних програм за визначеними критеріями [7].
Матеріали і методи. Досліджувані культури були отримані з музею лабораторії вивчення туберкульозу ННЦ «ІЕКВМ», Одеської дослідної станції ННЦ «ІЕКВМ», Інституту сільськогосподарської мікробіології (м. Чернігів) (табл. 1).
Дослідження проводили в лабораторії молекулярної діагностики ННЦ «ІЕКВМ» і референс-лабораторії вивчення туберкульозу і паратуберкульозу великої рогатої худоби Інституту ім. Фрідріха Льоффлера (Йєна, Німеччина).
ДНК готували за методом V.M. Hughes із співавт. [6] у модифікації Sirimalaisuwan A. [11].
Бактеріальну масу вирощували в бульйоні Meaddlebrook 7Н9 до отримання значення оптичної щільності суспензії OD588нм= 0,25-0,3, її інактивували за температури 75 °С протягом 20 хвилин та заморозили за температури мінус 80 °С на 12 годин. Після розтавання до суспензії додавали лізоцим (2 мг/мл) і інкубували за температури 37 °С протягом 1 години.
Агарозні блоки були виготовлені шляхом додавання 500 мкл гарячої бактеріальної суспензії до 500 мкл 1,2 %-го розчину агарози з низькою температурою плавлення («Biorad»). Затверділі агарозні блоки інкубували в ESP-лізуючому буфері (0,5 мМ ЕДТА, рН 8,0; 1 % SDS; 1,0 мг/мл протеїнази К («Roth») протягом 48 годин за температури 56 °С.
Після цього блоки були врівноважені за допомогою відповідного гідролітичного буфера за кімнатної температури протягом 1 години та інкубувались у 150 мкл гідролітичного буфера, що містив 20 ОД рестрикційної ендонуклеази XbaI («New England Biolabs»), протягом 4 годин за температури 37 °С. Електрофоретична сепарація фрагментів ДНК в 1,2 %-му агарозному гелі відбувалась на апараті «Rotaphor V» («Biometra») за наступним режимом: час імпульсів зростав із 5 до 35 секунд, 150-170 В, кут електродів - 115°-130°, температура 13 °C, швидкість ротору - 5, 3 x 14 год. Варіабельні параметри змінювалися логарифмічним способом. Електрофорезний буфер містив 0,25 х TBE, pH = 8,0. В якості референтної використовували ДНК Salmonella LT2, яка була оброблена рестриктазою XbaI. Гель був пофарбований бромідом етидія. Результати візуалізували під ультрафіолетовим світлом.
Обчислення результатів аналізу проводили шляхом сканування гелю. Подібність профілів, що основані на положенні смужок, обчислювали за допомогою програми GelСompar 4.1® (Applied Maths BVBA, Бельгія) із використанням алгоритму для розрахунку Ward & Dice коефіцієнта з максимальним відхиленням 1,8 % та критерієм оптимальності 0,5 %.
Результати досліджень. За допомогою ГЕПП було досліджено ДНК 23 культур мікобактерій (табл. 2). Після обробки рестриктазою Xba I спостерігали профілі, які налічували від 15 до 23 смужок (рис. 1).
Усі культури продемонстрували профілі, після порівняння яких in silico було сконструйовано дендрограму (рис. 2). У результаті аналізу профілів усі культури були розподілені на дві групи. До першої групи увійшли культури M. fortuitum, до другої – всі інші види.
Порівняння ізолятів M. fortuitum показало доволі високу ступінь гетерогенності всередині цього виду. Усі ізоляти M. fortuitum увійшли до однієї групи, що відокремлена від інших видів мікобактерій.
Групу M. fortuitum було розподілено на два великих клади, один з яких складається з профілів із 17 смужок, а другий – з профілів, що налічують 21-23 смужки. Від цих кладів, у свою чергу, відгалужені по два менших, до яких входять по 2 – 3 ізоляти, що виявились найбільш подібними один одному.
Три культури M. phlei (934, 938, 936) з профілями рестрикції, що складаються з 22 смужок та походять із Одеської, Кіровоградської областей та з музею лабораторії вивчення туберкульозу ННЦ «ІЕКВМ» відповідно, утворили окремий клад, до якого, однак, не потрапила культура M. phlei 940 (була ізольована в Харківській області) з профілем рестрикції 23 смужки. Остання культура увійшла до одного кладу з M. nonchromogenicum.
M. parascrofulaceum із профілем рестрикції 14 смужок виявилась наближеною до M. avium (19 смужок).
Культура 903 утворила профіль рестрикції, якому не відповідає жодний з описаних у літературі до теперішнього часу вид. Наближеною до цього профілю виявилась культура 909 (M. smegmatis). До одного кладу було згруповано культури 912 (M. engbakii) і 906 (M. duvalii) із профілями рестрикції з 15 і 18 смужок відповідно.
Обговорення результатів. Результати, отримані за допомогою ГЕПП, свідчать про можливість встановлення ступеня спорідненості двох або більше ізолятів мікобактерій одного виду між собою.
Генотипування з високою роздільною здатністю, проведене за допомогою ГЕПП, показало значний ступінь гетерогенності всередині досліджуваних штамів M. fortuitum. Ґрунтуючись на системі стандартизації при інтерпретації патернів ГЕПП у зв’язку з визначенням спорідненості штамів, запропонованій Tenover F.C. із співавт. [7], ми спостерігали дві групи профілів рестрикції ДНК.
Так, всі штами M. fortuitum, що мають профіль рестрикції, який складається з 17 смужок, мають походження з Чернігівської області (896, 898, 900, 904), окрім одного, який походить із Харківської області (892). Ці штами були відокремлені в окрему групу як більш споріднені (рис. 2). Натомість штами M. fortuitum, профіль рестрикції яких складається з 21 – 23 смужок, мають своє походження з Одеської області (885, 886, 887, 890, 891, 928, 955), за винятком одного штаму (955) з Чернігівської області. Ці штами, утворюючи більш складну популяцію, були також об’єднані в окремий клад (рис. 2).
Усі штами M. fortuitum утворюють специфічний профіль рестрикції, на основі якого їх було зведено в окрему групу відповідно до їх видової належності. Штами інших видів мікобактерій увійшли до другої великої групи. З огляду на невелику кількість досліджуваних культур їх розташування в кладах не можна вважати цілком відповідним дійсним філогенетичним зв’язкам. Характерним, однак, виявилось положення штаму 930, диференційованого як M. parascrofulaceum, який, незважаючи на різну кількість і розташування смужок, був розташований в дендрограмі в одному кладі з M. avium (рис. 2).
Висновки. Кожний окремий ізолят характеризується унікальним фінгерпринтингом, який полягає в різній кількості фрагментів рестрикції і їх молекулярній вазі, а отже і розташуванні в гелі. Поліморфізм патернів рестрикції дозволив сконструювати дендрограму, що демонструє високу ступінь гетерогенності штамів Mycobacterium fortuitum, які було розподілено на дві групи в залежності від регіону, де їх було ізольовано. За допомогою ГЕПП підтверджено дані про циркуляцію на території України Mycobacterium engbackii і Mycobacterium parascrofulaceum.
Перспективи. Генотипування за допомогою ГЕПП є ефективним інструментом молекулярно-епізоотологічних досліджень широкого спектра видів мікобактерій, який може бути використаний для встановлення ступеня генетичної спорідненості клінічних ізолятів.
Висловлюємо щиру подяку за надання культур мікобактерій канд. вет. наук Г. М. Дяченко, канд. вет. наук Н. В. Селіщевій, за допомогу в проведенні досліджень S. Werner і R. Putche, а також Німецькій службі академічних обмінів (DAAD) за надання фінансової підтримки в перебуванні в Німеччині і проведенні досліджень.
Список літератури
1. До питання діагностики туберкульозу тварин / Ю. Колос, В. Стець, В. Титаренко та ін. // Ветеринарна медицина України. – 2006. – №11. – С. 10 –12.
2. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – Москва, РФ. – 2005. – 397 С.
3. Analysis of multidrug-resistant Mycobacterium bovis from three clinical samples from Scotland / V.M. Hughes, R. Skuce, C. Doig et al. // Int. J. Tuberc. Lung. Dis. – 2003. – Vol. 7(12). – P. 1191 – 1198.
4. Comparative macrorestriction and RFLP analysis of Mycobacterium avium subsp. avium and Mycobacterium avium subsp. hominissuis isolates from man, pig, and cattle / P. Möbius, P. Lentzsch, I. Moser et al. // Vet. Microbiol. – 2006. – Vol. 117. – P. 284 – 291.
5. Evaluation of the relatedness of strains of Mycobacterium avium using pulsed-field gel electrophoresis / D.R. Burki, C. Bernasconi, T. Bodmer, A. Telenti // Eur. J. Clin. Microbiol. Infect. Dis. – 1995. – Vol. 14. – P. 212 – 217.
6. Hughes V.M., Stevenson K., Sharp J.M. Improved preparation of high molecular weight DNA for pulsed-field gel electrophoresis from mycobacteria // Journal of Microbiological Methods. – 2001. – Vol. 44. – P. 209 – 215.
7. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing / F.C. Tenover, R.D. Arbeit, R.V. Goering et al. // J. Clin. Microbiol. – 1995. – Vol. 33, No. 9. – P. 2233 – 2239.
8. Moser I. Tuberkulose Erregerreservoir: Wild. Oral presentation at a satellite symposium (Subgroup of the German Veterinary Society: Epizootics Control) at the World Buiatric Congress, Hannover, Germany, 2002.
9. Niemann S. Usefulness of molecular strain typing in the detection of transmission dynamics of tuberculosis // Materials of 24th Ann. Congr. Eur. Soc. Mycobacteriology. – 29 June – 2 July 2003, Tartu, Estonia. – P. 6.
10. Philipp W.J., Gordon S., Telenti A., Cole S.T. Pulsed field gel electrophoresis for Mycobacteria / Parish T., Stoker N.G. // Mycobacteria protocols. Methods in molecular biology, Vol. 101. – Humana Press, Totowa, New Jersey, USA, 1998. – P.51-64.
11. Sirimalaisuwan A. Molecular biological studies on Mycobacterium avium-intracellulare complex isolated from slaughtered pigs and wildlife animals in Germany: Innaug.-Diss. zur Erlang. Grad. Doktor Veterinarmedizin an der Freien Universitat; Berlin, 2004. – 93 S.
Genotyping of Mycobacteria by Pulsed Field Gel Electrophoresis
Skrypnyk А., DVM, PhD, SR
Zavgorodnii А., DVM, Prof., Cor.-member UAAS,
Stegniy B., DVM, Prof., Acad. UAAS
National Scientific Center «Institute of Experimental and Clinical Veterinary Medicine»,
Kharkiv
Skrypnyk V., DVM, PhD, SR
State Scientific Control Institute for Biotechnology and Strains of Microorganisms, Kiev
Moser I., Dr. Rer. Nat., PD
Friedrich-Loeffler Institute, Jena, Germany
Abstract
The article presents the principle of pulsed field gel electrophoresis (PFGE) and fingerprinting results of 23 mycobacterium strains, isolated in different regions of Ukraine. The dendrogram drawn on the basis of pattern polymorphism showed high heterogeneity among the strains of Mycobacterium fortuitum, which were divided into two clusters depending from the region of isolation. Data concerning the circulation of Mycobacterium engbaekii and Mycobacterium parascrofulaceum on the territory of Ukraine was confirmed. The possibility of PFGE application for determination of the genetic relatedness of the variety of Mycobacterium species was shown.
Таблиця 1 – Джерело, регіон, рік виділення, номер експертизи і лабораторний номер досліджуваних культур.
|
№ експ. |
Звідки виділено |
Регіон та рік виділення |
№ культури |
|
10 |
курка |
Одеська обл., 1995 |
885 |
|
13 |
ВРХ |
Одеська обл. |
886 |
|
14 |
ВРХ |
Одеська обл., 1998 |
887 |
|
12 |
ВРХ |
Одеська обл. |
890 |
|
8 |
ВРХ |
Одеська обл. |
891 |
|
81 |
індичка (легені, селезінка) |
Харківська обл., 2001 |
892 |
|
ЛП-13 |
курка (печінка) |
Чернігівська обл., 1999 |
896 |
|
ТАЛ-22 |
курка (збірна проба) |
Чернігівська обл., 1998 |
898 |
|
Г234 |
галка (збірна проба) |
Чернігівська обл., 2001 |
900 |
|
ДЛ-5 |
ВРХ (лімфовузли) |
Чернігівська обл., 2002 |
903 |
|
КЛ-111 |
ВРХ (лімфовузли) |
Чернігівська обл., 2001 |
904 |
|
ДЛ-6 |
ВРХ (лімфовузли) |
Чернігівська обл., 2002 |
906 |
|
ДЛ-4 |
ВРХ (лімфовузли) |
Чернігівська обл., 2002 |
909 |
|
ДГК-8 |
ВРХ (кров) |
Чернігівська обл., 2002 |
912 |
|
18 |
ВРХ |
Одеська обл., 1998 |
928 |
|
44 |
вода зі ставка-накопичувача |
Донецька обл., 1985 |
930 |
|
42 |
стік, ставок |
Донецька обл., 1986 |
931 |
|
20 |
ВРХ |
Одеська обл., 1998 |
934 |
|
25 |
музей |
Москва |
936 |
|
28 |
гній |
Кіровоградська обл., 1984 |
938 |
|
26 |
ВРХ (лімфовузли) |
Харківська обл., 1984 |
940 |
|
60 |
ґрунт вигону |
Черкаська обл. |
945 |
|
ІП-220 |
підстилка з пташника |
Чернігівська обл., 1999 |
955 |
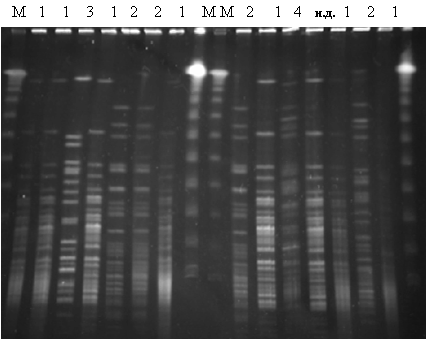
Рис. 1. Електрофореграма результатів ГЕПП; 1 - M. fortuitum; 2 - M. phlei; 3 - M. nonchromogenicum; 4 - M. duvalii; M - маркер молекулярної ваги; н.д. - не диференційовано.
Таблиця 2 – Результати порівняння патернів мікобактерій, отриманих за допомогою ГЕПП
|
№ культури |
Вид мікобактерії |
Кількість фрагментів патерну |
|
885 |
fortuitum |
21 |
|
886 |
fortuitum |
21 |
|
887 |
fortuitum |
23 |
|
890 |
fortuitum |
22 |
|
891 |
fortuitum |
23 |
|
892 |
fortuitum |
17 |
|
896 |
fortuitum |
17 |
|
898 |
fortuitum |
17 |
|
900 |
fortuitum |
17 |
|
903 |
sp.LIV-2255 |
17 |
|
904 |
fortuitum |
17 |
|
906 |
duvalii |
18 |
|
909 |
smegmatis |
21 |
|
912 |
engbaekii |
15 |
|
928 |
fortuitum |
23 |
|
930 |
parascrofulaceum |
14 |
|
931 |
avium |
19 |
|
934 |
phlei |
22 |
|
936 |
phlei |
22 |
|
938 |
phlei |
22 |
|
940 |
phlei |
23 |
|
945 |
nonchromogenicum |
15 |
|
955 |
fortuitum |
23 |
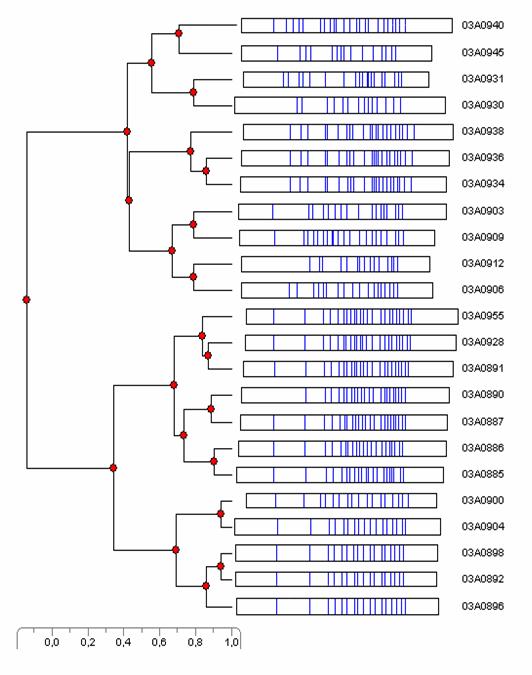
Рис. 2. Безкоренева ГЕПП дендрограма, згенерована після рестрикції ферментом Xba I.
|
|
Скрыпник А. В.
Кандидат ветеринарных наук
Старший научный сотрудник лаборатории молекулярной диагностики
Национальный научный центр «Институт экспериментальной и клинической ветеринарной медицины»
г. Харьков, ул. Пушкинская 83, 61023 Украина |
|



