❶Главная
/
❷Медицинские публикации
/
❸Ветеринария
/
ПРИМЕНЕНИЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ МЕТОДОВ ДЛЯ ИЗУЧЕНИЯ ВИДОВОГО СООТНОШЕНИЯ МИКОБАКТЕРИЙ, ИЗОЛИРОВАННЫХ В УКРАИНЕ ОТ РЕАГИРОВАВШЕГО НА ТУБЕРКУЛИН КРС
УДК 619:616.98:579.873.21:577.21:616-076
ПРИМЕНЕНИЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ МЕТОДОВ ДЛЯ ИЗУЧЕНИЯ ВИДОВОГО СООТНОШЕНИЯ МИКОБАКТЕРИЙ, ИЗОЛИРОВАННЫХ В УКРАИНЕ ОТ РЕАГИРОВАВШЕГО НА ТУБЕРКУЛИН КРС
А.В. Скрыпник
Национальный научный центр «Институт экспериментальной и клинической ветеринарной медицины», г. Харьков, Украина
Резюме
В статье изложены результаты молекулярно-генетического скрининга 80 культур микобактерий, изолированных в Украине от КРС, реагировавшего на туберкулин для млекопитающих. Показано, что процент изолятов M. tuberculosis complex (M. bovіs и M. caprae) составляет лишь 18,75 % от общего количества выделенных культур. Продемонстрирована превалирующая роль M. аvium complex (30,0 % изолятов), в частности M. avium subsp. hominissuis (21,25 %), и M. fortuitum (21,25 %) в сенсибилизации КРС к туберкулину. Показана необходимость широкого применения в лабораторной практике молекулярно-генетических методов диагностики туберкулеза.
Введение
Проблема туберкулеза является актуальной как для гуманной, так и для ветеринарной медицины. Приблизительно треть населения земного шара инфицирована бактериями, принадлежащими к Mycobacterium tuberculosis complex (21, 23, 28).
Несмотря на значительные достижения ветеринарной службы в борьбе с туберкулезом, эта опасная зооантропонозная инфекция регистрируется в ряде регионов как Украины, так и Российской Федерации. Сумма убытков, причиняемых инфекцией Mycobacterium bovis сельскому хозяйству всего мира, достигает ежегодно 3 млрд. долларов (26).
В настоящее время диагностика туберкулеза в странах СНГ осуществляется с применением комплекса эпизоотологического, аллергического, патологоанатомического и бактериологического методов исследований.
Аллергическая диагностика туберкулеза усложняется наличием неспецифических реакций на туберкулин для млекопитающих, обусловленных непатогенными для животных атипичными микобактериями (7). Определение эпизоотической ситуации по туберкулезу в стадах животных возможно благодаря применению симультанной пробы, в комплексе с другими методами (1). Во многих благополучных по туберкулезу хозяйствах этиологический фактор реактивности КРС к туберкулину остается неустановленным (8), а методы дифференциации специфических и неспецифических реакций на туберкулин требуют дальнейшего усовершенствования.
Согласно действующей в Украине Инструкции "О мероприятиях по профилактике и оздоровлению животноводства от туберкулеза", результаты лабораторных исследований с учетом эпизоотологических данных являются регламентирующими в постановке диагноза. В лабораториях ветеринарной медицины применяют методы бактериологической диагностики, в частности определения фенотипических признаков микобактерий (кислотоустойчивость, характер и скорость роста колоний, наличие или отсутствие определенных биохимических характеристик, вирулентность для лабораторных животных и т.п.) (2, 4, 10). Существующая методика идентификации и видовой дифференциации микобактерий, включающая в себя более десяти культурально-морфологических, биохимических и биологических тестов, трудоемка и позволяет в течение 30–90 суток определить видовую принадлежность только около 20 из более чем 90 систематизированных видов микобактерий (2, 10, 13, 14, 27).
Разработка методов ранней диагностики этой инфекции является важнейшей составляющей системы контроля распространения туберкулеза. Развитие новейших технологий на основе полимеразной цепной реакции (ПЦР) и секвенирования открывает новые перспективы в диагностике туберкулеза, в частности детекции и дифференциации возбудителей, проведение их генотипирования и молекулярно-эпизоотологического мониторинга (15, 17, 21). Перспективность использования молекулярно-генетических методов заключается в их универсальности, надежности, очень высокой специфичности и чувствительности, значительном сокращении сроков проведении диагностики туберкулеза (3, 27). Применение этих методов дает возможность установления или опровержения диагноза туберкулез в хозяйствах путем подтверждения наличия атипичных микобактерий и отсутствия микобактерий туберкулезного комплекса, предотвращая вынужденный забой скота, и проведения оздоровительных мероприятий в более короткое время.
Материалы и методы
Исследования проводили в лаборатории молекулярной диагностики Национального научного центра "Институт экспериментальной и клинической ветеринарной медицины" (г. Харьков, Украина), лаборатории генной инженерии и Национальной референс-лаборатории по изучению туберкулеза и паратуберкулеза КРС Федерального исследовательского института здоровья животных имени Ф. Лёффлера (г. Йена, Германия).
Исследовано 80 культур микобактерий, изолированных от КРС, который реагировал на введение туберкулина для млекопитающих и забитого с диагностической целью, на территории Запорожской, Кировоградской, Киевской, Луганской, Николаевской, Одесской, Харьковской, Херсонской, Черниговской областей в период с 1998 по 2004 год. Культуры микобактерий были любезно предоставлены д.вет.н., проф. А.И. Завгородним (ННЦ «ИЭКВМ»), к.вет.н. А.М. Дяченко (Черниговский институт сельскохозяйственной микробиологии УААН), к.вет.н. Н.В. Селищевой (Одесская исследовательская станция ННЦ «ИЭКВМ»).
Рекультивирование всех исследуемых культур осуществляли одновременно на 4 питательных средах: 7Н9 и 7Н10 Meaddlebrook, Stonebrіnk, Ogawa. Пробирки с посевами инкубировали при температуре 37–38 °С в аэробных условиях до накопления достаточного количества бактериальной массы.
ДНК экстрагировали из бактериальной массы способом ультразвуковой дезинтеграции клеток (35 кГц, 10 минут) с последующей их обработкой нагреванием при температуре 99–100 °С в течение 10 минут. ДНК сепарировали центрифугированием при 12000 об/мин в течение 5 минут. Для дальнейших исследований использовали полученный супернатант.
Полимеразную цепную реакцию применяли для индикации рода Mycobacterium с последующей дифференциацией M. tuberculosis complex, M. bovis, M. tuberculosis, M. avium complex (с дальнейшим типированием его до подвидов), M. intracellulare, как описано в (12).
Сполиготайпинг. Для проведения сполиготайпинга использовали коммерческий набор ІM9702 (Іsogen Bіoscіence BV). Амплификацию спейсеров осуществяли с помощью ПЦР с использованием праймеров DRa (CCG AGA GGG GAC GGA AAC) и DRb (GGT TTT GGG TCT GAC GAC), праймер DRa мечен биотином (24).
Мастер-микс готовили в объеме 50 мкл на 1 пробу: 5,0 мкл 10x ПЦР-буфера (с 1,5 мМ MgCl2); 1,0 мкл смеси дНТФ (10 мМ); по 4,0 мкл праймеров DRa и DRb (20 пМ/мкл); 0,4 мкл Taq-полимеразы (5 ЕД/мкл); y мкл воды для ПЦР (y = 35,6 мкл - x). К мастер-миксу прибавляли x мкл образца ДНК.
Параметры амплификации: первичная денатурация – 96 °С, 180 сек; денатурация – 96 °С, 60 сек; отжиг – 55 °С, 60 сек; элонгация – 72 °С, 30 сек; финальная элонгация – 72 °С, 300 сек; циклов – 35.
Смесью из 20 мкл ПЦР-продукта и 150 мкл 2хSSPE/0,1%SDS после температурной обработки заполняли слоты миниблоттера с заранее помещенной туда мембраной (Іsogen Bіoscіence BV) и проводили гибридизацию в течение 1 ч при 60 °С. После этого мембрану помещали в бутыль и дважды обрабатывали буфером 2хSSPE/0,1%SDS по 10 минут, вращая с помощью ротатора. Результаты гибридизации выявляли на основе хемилюминисценции путем инкубации мембраны в буфере 2хSSPE/0,5%SDS с 2,5 мкл конъюгата стрептавидин-пероксидазы (Roche), а затем путем обработки ECL™ реагентом для вестерн-блоттинга с последующей детекцией на фотопленке (Hyperfіlm™ECL™, Amersham pharmacіa bіotech).
Форматирование бинарного кода в восьмеричный осуществляли по алгоритму Dale J.W. и соавт. (25). Анализ результатов проводили с использованием базы данных SpolDB4 (20).
Секвенирование. Секвенировали гипервариабельный участок гена 16S рибосомальной РНК (с 129 по 266 позицию относительно картирования E. colі), для чего этот участок амплифицировали методом ПЦР с использованием праймеров М285 (GAG AGT TTG ATC CTG GCT CAG; позиция отжига 9-30) и М264 (TGC ACA CAG GCC ACA AGG GA; позиция отжига 1046-1027).
Мастер-микс на 1 пробу содержал: 5 мкл буфера для ПЦР (10х); 2 мкл смеси дНТФ (2 мм); по 1 мкл растворов праймеров (20 пМ); 0,2 мкл Taq-полимеразы (5 ЕД/мкл); 39,8 (38,8) мкл деионизированной воды. Образец ДНК вносили в объеме 1-2 мкл. Амплификацию осуществляли по такой программе: первичная денатурация – 96 °С, 60 секунд; денатурация – 96 °С, 30 секунд; отжиг – 58 °С, 60 секунд; элонгация – 72 °С, 60 секунд; финальная элонгация – 72 °С, 300 секунд; количество циклов – 35.
Ампликоны очищали с помощью QіAquіck Gel Extractіon Kіt (Qіagen, Германия). Очищенный таким образом ПЦР-продукт использовали для сиквенс-амплификации с одним праймером М285, для чего смешивали 4 мкл деионизированной воды; 2,5 мкл готового мастер-микса "Termіnator Ready Reactіon Mіx (Bіg Dye)", который содержал флуоресцентно меченные дНТФ (терминаторы) (ABІ PRІSM Dye Termіnator Cycle-Sequencіng Ready Reactіon Kіt, Applіed Bіosystems); 2 мкл очищенного ПЦР-продукта (приблизительно 50-70 нг ДНК); 1 мкл праймера (3,2 пМ). Амплифицировали по такой программе: первичная денатурация – 96 °С, 60 секунд; денатурация – 96 °С, 30 секунд; отжиг – 50 °С, 60 секунд; элонгация – 60 °С, 240 секунд; количество циклов – 25.
После амплификации осуществляли автоматическое секвенирование ДНК на секвенаторе ABІ PRІSM 310 Genetіc Analyser (Applіed Bіosystems, США). Определение вида исследуемых микобактерий осуществляли с использованием таких баз данных, как GenBank (www.ncbі.nlm.nіh.gov/entrez (16)), EMBL (www.ebі.ac.uk/embl), DDBJ (www.ddbj.nіg.ac.jp), RІDOM (www.rіdom-rdna.de (22)).
Результаты и обсуждение
Полимеразная цепная реакция. Все исследованные культуры были положительны в ПЦР с родоспецифическими праймерами. По результатам исследований в ПЦР с праймерами, комплементарными IS 6110, к M. tuberculosis complex отнесено 15 из 80 культур, т.е. 18,75 %. Все эти культуры были дифференцированы как M. bovis в ПЦР с праймерами, специфичными этому возбудителю. В то же время они были негативны с праймерами, специфичными M. tuberculosis.
Из 80 исследованных культур положительными в ПЦР с праймерами, специфичными M. avium complex, были 24 культуры, что составило 30 %. Из них 7 культур (8,75 %) было типировано как M. avium subsp. avium, 17 культур – как M. avium subsp. hominissuis (21,25 %) (табл. 1).
Таблица 1
Результаты типирования культур M. avium complex
| № культуры |
M.a.a., M.a.s., M.a.h. (IS1245) |
M.a.a, M.a.s. (IS901) |
M.a.a, M.a.s. (IS902) |
M.a.h. (FR300) |
M. intracellul. (16S рДНК) |
Результат типирования |
| 889 |
+ |
+ |
+ |
- |
n |
Maa |
| 913 |
+ |
+ |
+ |
- |
n |
Maa |
| 914 |
+ |
- |
- |
+ |
- |
Mah |
| 915 |
+ |
+ |
+ |
- |
- |
Maa |
| 916 |
+ |
- |
- |
+ |
n |
Mah |
| 917 |
+ |
- |
- |
+ |
- |
Mah |
| 918 |
+ |
+ |
+ |
- |
- |
Maa |
| 919 |
+ |
- |
- |
± |
- |
Mah |
| 920 |
+ |
- |
- |
+ |
n |
Mah |
| 921 |
+ |
+ |
+ |
- |
- |
Maa |
| 922 |
+ |
- |
- |
+ |
n |
Mah |
| 923 |
+ |
- |
- |
+ |
- |
Mah |
| 924 |
+ |
- |
- |
+ |
- |
Mah |
| 925 |
+ |
- |
- |
+ |
- |
Mah |
| 926 |
+ |
- |
- |
+ |
n |
Mah |
| 927 |
+ |
- |
- |
+ |
- |
Mah |
| 941 |
+ |
- |
- |
+ |
n |
Mah |
| 950 |
+ |
- |
- |
+ |
n |
Mah |
| 951 |
+ |
+ |
+ |
- |
- |
Maa |
| 952 |
+ |
- |
- |
+ |
n |
Mah |
| 953 |
+ |
- |
- |
+ |
- |
Mah |
| 958 |
+ |
- |
- |
+ |
- |
Mah |
| 1441 |
+ |
+ |
+ |
- |
- |
Maa |
| 1528 |
+ |
- |
- |
+ |
- |
Mah |
«+» – реакция позитивная; «-» – реакция негативная; «±» – реакция сомнительная; «n» – реакцию не проводили; Maa – M. avium subsp. avium; Mah – M. avium subsp. hominissuis; Mas – M. avium subsp. silvaticum; M. intracellul. – M. intracellulare
Сполиготайпинг. 15 культур, дифференцированных методом ПЦР как M. bovis, были исследованы с помощью сполиготайпинга (табл. 2). Из них 12 было дифференцировано как M. bovis, 3 – как M. caprae.
Таблица 2
Схематическое отображение профилей гибридизации культур микобактерий с помощью сполиготайпинга
|
№ культуры |
Спейсери сполігопрофілю
1 10 20 30 43 |
Результат дифференциации |
|
901 |
■■□■■■■■□■■■■■■□■■■■■■■■■■■■■■■■■■■■■■□□□□□ |
M. bovіs |
|
1502 |
■■□■■■■■□■■■■■■□■■■■■■■■■■■■■■□■■■■□■■□□□□□ |
M. bovіs |
|
1503 |
■■□■■■■■□■■■■■■□■■■■■■■■■■■■■■■■■■■■■■□□□□□ |
M. bovіs |
|
1505 |
□■□□□□□□□□□□□□□□■■■■■■■■■□□□□□■■■■□■■■□□□□□ |
M. caprae |
|
1511 |
■□□■■■■■□■■■■■□□■■■■□□■■■■□■■■■■■■■□■■□□□□□ |
M. bovіs |
|
1520 |
■■□■■■■■□■■■■■□□■■■■■■■■■■■■■■□■■■■□■■□□□□□ |
M. bovіs |
|
1521 |
■■□■■■■■□■■■■■■□■■■■■■■■■■■■■■□■■■■□■■□□□□□ |
M. bovіs |
|
1523 |
■□□□□□■■□□■■□■□□■■■□□■■■■■□■□■□□■■□□■■□□□□□ |
M. bovіs |
|
1527 |
■□□□□□■■□□■■□■□□■■■□□■■■■■□■□■□□■■□□■■□□□□□ |
M. bovіs |
|
1539 |
■□□□□□■■□□■■□■□□■■■□□■■■■■□■□■□□■□□□□■□□□□□ |
M. bovіs |
|
1544 |
□■□□□□□□□□□□□□□□■■■■■■■■■■■□■■■■■■■■■■□□□□□ |
M. caprae |
|
1545 |
□■□□□□□□□□□□□□□□■■■■■■■■■■■□■■■■■■■■■■□□□□□ |
M. caprae |
|
1546 |
■□□□□□■■□□■■□■□□■■■□□■■■■■□■□■□□■■□□■■□□□□□ |
M. bovіs |
|
1547 |
■□□□□□■■□□■■□■□□■■■□□■■■■■□■□■□□■■□□■■□□□□□ |
M. bovіs |
|
1548 |
■□□□□□■■□□■■□■□□■■■□□■■■■■□■□■□□■■□□■■□□□□□ |
M. bovіs |
«■» – наличие спейсера; «□» – отсутствие спейсера
Секвенирование. Видовую принадлежность 41 культуры микобактерий, вид которых установить методом ПЦР не удалось и потому отнесенных к атипичным, определяли с помощью секвенирования гипервариабельного участка 16S рДНК (табл. 3).
Таблица 3
Результаты видовой дифференциации атипичных микобактерий с помощью секвенирования 16S рДНК
|
Вид микобактерий |
Количество изолятов |
Процент от общего количества культур (%) |
|
M. fortuitum |
17 |
21,3 |
|
M. nonchromogenicum |
7 |
8,8 |
|
M. phlei |
6 |
7,5 |
|
M. thermoresistibile |
2 |
2,5 |
|
M. duvalii |
2 |
2,5 |
|
M. hassiacum |
1 |
1,3 |
|
M. smegmatis |
1 |
1,3 |
|
M. frederiksbergense |
1 |
1,3 |
|
M. engbaekii |
1 |
1,3 |
|
M. doricum |
1 |
1,3 |
|
M. parascrofulaceum |
1 |
1,3 |
|
M. elephantis |
1 |
1,3 |
Видовой состав исследованных микобактерий, изолированных из органов КРС, представлен на рисунке 1. Как свидетельствуют данные этого рисунка, наряду с представителями M. tuberculosis complex (M. bovіs и M. caprae), на долю которых приходится 18,75 %, от КРС чаще всего выделяются такие виды атипичных микобактерий: M. avium complex – 30,0 % (причем количество изолятов M. avіum subsp. homіnіssuіs в 2,4 раза превышает количество изолятов M. avіum subsp. avіum); M. fortuіtum – 14,4 %; M. nonchromogenіcum – 7,8 %; M. phleі – 6,7 %. Количество других 9 видов атипичных микобактерий, выделенных от КРС, также весомо, однако их изолирование является единичными случаями.
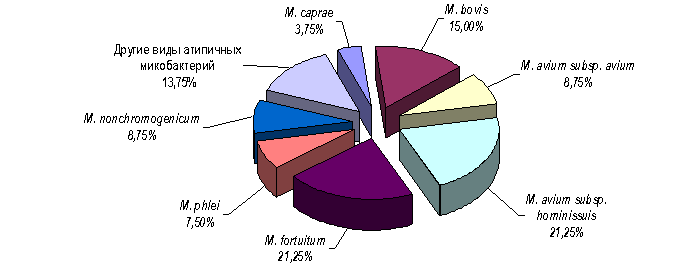
Рисунок 1. Процентное соотношение видов микобактерий, изолированных от КРС (n = 80) 
Рисунок 2. Процентное соотношение атипичных видов микобактерий, изолированных от КРС (n = 65)
Анализируя результаты, необходимо отметить невысокий процент выделенных из органов реагировавшего на туберкулин КРС изолятов микобактерий, дифференцированных как M. bovіs и M. caprae, на долю которых приходится лишь одна пятая от всех изолятов. Полученные данные ставят под сомнение специфичность как туберкулина, использовавшегося для проведения аллергических исследований, так и самого метода туберкулинизации, и свидетельствуют о необходимости обязательного применения как симультанной аллергической пробы, так и молекулярно-генетических методов диагностики туберкулеза.
Обращает на себя внимание высокий процент (30 %) изолятов M. avіum. Полученные результаты не сходятся с данными официальной отчетности ветеринарной службы Украины, согласно которым за период с 1998 по 2004 гг. процент выделения от КРС M. avіum составил в среднем 2,8 %. Данная ситуация может быть объяснена несовершенством применяемых в лабораторной практике методов дифференциальной диагностики, основанных на изучении фенотипических признаков микобактерий.
Наличие штаммов M. avіum complex в продуктах животноводческого происхождения представляет угрозу возможной трансмиссии этой инфекции человеку, в частности ВИЧ инфицированным. При этом нетуберкулезные микобактериозы являются основной причиной летальных случаев больных СПИДом (5, 18, 19, 23, 28).
Организм животного представляет собой благоприятную среду для селекции вирулентных для человека штаммов оппортунистических видов микобактерий, в частности M. avіum complex. Поэтому внедрение мероприятий, направленных на расширение спектра применяемых диагностических средств, в частности использование полимеразной цепной реакции, усилит контроль над распространением МАС и явится важным условием предотвращения передачи этой инфекции потребителям животноводческой продукции.
Закономерный интерес вызывает также вопрос столь высокого (81,25 %) процента выделения от КРС атипичных микобактерий.
По нашему мнению, это может быть обусловлено значительной степенью сенсибилизации КРС атипичными микобактериями, предопределяя парааллергические реакции на туберкулин, что согласуется с данными А.И. Завгороднего (2), В.М. Горжеева (7), В.П. Шишкова и В.П. Урбана (6). Проникновению в организм и размножению атипичных микобактерий способствуют несоответствующие санитарно-гигиенические условия содержания животных (7, 9, 11), когда эти микобактерии получают возможность развиваться в чрезвычайно ослабленном организме.
Наибольшую роль в сенсибилизации КРС к туберкулину, очевидно, играют M. avіum complex, в частности M. avіum subsp. homіnіssuіs, и M. fortuіtum. Полученные нами результаты относительно видового состава атипичных микобактерий, чаще всего выделяющихся от КРС, наводят на мысль о возможности усовершенствования аллергических исследований туберкулеза повышением их специфичности путем использования для симультанной аллергической пробы M. avіum subsp. homіnіssuіs и M. fortuіtum.
Другой причиной выделения атипичных микобактерий может быть смешанная инфекция, вызванная патогенными видами комплекса M. tuberculosіs, благодаря чему убиквитарные атипичные микобактерии получили возможность своего развития в пораженном организме. Во время исследований атипичные микобактерии не дали возможности исследовать в смешанных культурах действительно патогенные микобактерии из-за их быстрого роста, который подавил рост патогенных микобактерий. Еще одной причиной может быть лабораторная контаминация изолированных патогенных культур атипичными микобактериями.
Выводы
1. Существующие проблемы специфичности прижизненной диагностики туберкулеза КРС, связанные с явлением парааллергических реакций, обусловленных сенсибилизацией организма персистенцией атипичных микобактерий, могут быть решены благодаря широкомасштабному применению в ветеринарной фтизиатрии молекулярно-генетических методов, в частности полимеразной цепной реакции, которые являются рутинными в лабораторной диагностике развитых стран и дают возможность поставить этот опасный зооантропоноз под жесткий контроль.
2. При изучении атипичных микобактерий, выделенных от КРС, реагировавшего на туберкулин для млекопитающих, установлено, что главная роль в сенсибилизации КРС принадлежит M. аvium complex (36,92 % изолятов среди атипичных видов микобактерий), в частности M. avium subsp. hominissuis – 26,15 %, і M. fortuitum (26,15 %), на долю M. nonchromogenicum приходится 10,77 %, M. phlei – 9,23 %, других 9 видов атипичных микобактерий – 16,92 %.
3. Повышение специфичности аллергической диагностики туберкулеза КРС может быть осуществлено путем использования для симультанной аллергической пробы M. avіum subsp. homіnіssuіs и M. fortuіtum, что нуждается в подтверждении широкомасштабными исследованиями.
4. С помощью секвенирования впервые в Украине получены данные о выделении от КРС таких видов атипичных микобактерий, как M. frederіksbergensе, M. dorіcum, M. parascrofulaceum, M. hassіacum, M. elephantіs.
Выражаем благодарность за помощь в проведении исследований Dr. K. Sachse, Dr. I. Moser, Dr. H. Hotzel (Friedrich Loeffler Institut), и за возможность проведения исследований Немецкой службе академических обменов (DAAD).
Список литературы
1. Достижения науки и практики в борьбе с туберкулезом животных в хозяйствах Украины / Ю.Я. Кассич [и др.] // Ветеринарная патология. – 2004. – № 1–2 (9). – С.38-41.
2. Завгородний, А.И. Виды микобактерий, распространенные в хозяйствах Украины, и их эпизоотическое значение: дис… д-ра вет наук: 16.00.03 / Завгородний Андрей Иванович. – Х., 1997. – 298с.
3. Костюк, Р.В. ПЦР при контроле благополучия скота по туберкулезу / Р.В. Костюк // Ветеринарная патология. – 2004. – № 1-2 (9). – С.105-107.
4. Методические рекомендации по уточнению диагноза на туберкулез у крупного рогатого скота благополучных хозяйств и определению видовой принадлежности культур микобактерий / Ю.Я. Кассич [ и др.] // Украинский научно-исследовательский институт экспериментальной ветеринарии. – Х., 1987. – 19 с.
5. Пузанов, В.А. Бактериемия при туберкулезе и других микобактериальных инфекциях / В.А. Пузанов, М.В. Косарева // Проблемы туберкулеза. – 1999. – № 1. – С.54-59.
6. Шишков, В.П. Туберкулез сельскохозяйственных животных / В.П. Шишков, В.П. Урбан. – М.: Агропромиздат, 1991. – 255 с.
7. Горжеєв, В.М. Епізоотологічний моніторинг та удосконалення системи боротьби з туберкульозом великої рогатої худоби у господарствах України: дис … канд. вет. наук: 16.00.08 / Горжеєв Володимир Михайлович. – Х., 2005. – 126с.
8. Динаміка епізоотологічного процесу при мікобактеріальних інфекціях великої рогатої худоби в господарствах Причорномор’я / Н. Селіщева [та ін.] // Ветеринарна медицина України. – 2006. – № 12. – С.12-14.
9. До питання діагностики туберкульозу тварин / Ю. Колос [та ін.] // Ветеринарна медицина України. – 2006. – № 11. – С.10-12.
10. Дяченко, Г. Проблема діагностики туберкульозу сільськогосподарських тварин у сучасних умовах / Г. Дяченко, Н. Кравченко, В. Романенко // Ветеринарна медицина України. – 2006. – № 1. – С.5-7.
11. Зелінський, М. Туберкульоз великої рогатої худоби. Причини виникнення та фактори, що стримують оздоровлення неблагополучних господарств / М. Зелінський // Ветеринарна медицина України. – 2000. – № 6. – С.15-16.
12. Скрипник А.В. Молекулярно-генетична диференціація мікобактерій, виділених в Україні, та їх філогенетичні взаємозв’язки: дис… канд. вет. наук: 16.00.03 / Скрипник Артем Валерійович. – Х., 2007. – 182 с.
13. Conventional methods versus 16S ribosomal DNA sequencing for identification of nontuberculous Mycobacteria: cost analysis / V.J. Cook [et al.] // J. Clin. Microbiol. – 2003. – Vol. 41. – P.1010-1015.
14. Dostal, S. Concise guide to mycobacteria and their molecular differentiation / S. Dostal, E. Richter, D. Harmsen. – Würzburg: Ridom Press, 2003. – P.206.
15. Dvorska, L. Strategies for differentiation and typing of medically important species of mycobacteria by molecular methods / L. Dvorska [et al.] // Vet. Med. – 2001. – Vol.46. – P.11-12.
16. GenBank / D.A. Benson [et al.] // Nucleic Acids Res. – 2005. – Vol. 1, № 33 (Database issue). – P. 34-38.
17. Haddad, N. Molecular differentiation of Mycobacterium bovis isolates. Review of main techniques and applications / N. Haddad, M. Masselot, B. Durand // Research in Veterinary Science. – 2004. – Vol. 76. – P.1-18.
18. Horsburgh, C.R. Jr. Epidemiology of Mycobacterium avium Complex Disease / C.R. Horsburgh // American Journal of Medicine. – 1997. – Vol. 102, №5. – P.11-15.
19. Koh, W.-J. Nontuberculous mycobacterial pulmonary diseases in immunocompetent patients / W.-J. Koh, O.J. Kwon, K.S. Lee // Korean J. Radiol. – 2002. – № 3. – Р.145-157.
20. Mycobacterium tuberculosis complex genetic diversity: mining the fourth international spoligotyping database (SpolDB4) for classification, population genetics and epidemiology / K. Brudey [et al.] // BMC Microbiol. – 2006. – № 6. – P.23.
21. Rastogi, N. The mycobacteria: an introduction to nomenclature and pathogenesis / N. Rastogi, E. Legrand, C. Sola // Rev. sci. tech. Off. Int. Epiz. – 2001. – Vol. 20, №1. – Р.21-54.
22. RIDOM: comprehensive and public sequence database for identification of Mycobacterium species / D. Harmsen [et al.] // BMC Infect. Dis. – 2003. – Vol. 3. – P.26.
23. Schütt-Gerowitt, H. On the development of Mycobacterial infections / H. Schütt-Gerowitt // Zbl. Bakt. – 1995. – Bd. 283. – S.5-13.
24. Simultaneous detection and strain differentiation of Mycobacterium tuberculosis for diagnosis and epidemiology / J. Kamerbeek [et al.] // Journal of Clinical Microbiology. – 1997. – P.907-914.
25. Spacer oligonucleotide typing of bacteria of the Mycobacterium tuberculosis complex: recommendations for standartised nomenclature / J.W. Dale [et al.] // International journal of tuberculosis and lung diseases. – 2001. Vol. 5, № 3. – P.216-219.
26. The complete genome sequence of Mycobacterium bovis / T. Garnier [et al.] // PNAS. – 2003. – Vol. 100, №.13. – P.7877-7882.
27. Two-laboratory collaborative study on identification of mycobacteria: molecular versus phenotypic methods / B. Springer [et al.] // J. Clin. Microbiol. – 1996. – Vol. 34. – P.296-303.
28. World Health Organization. Fact sheet No.104. – 2006. – [Electronic recourse]. – Mode of access: http://www.who.int/mediacentre/factsheets/fs104/en/index.html
|
|
Скрыпник А. В.
Кандидат ветеринарных наук
Старший научный сотрудник лаборатории молекулярной диагностики
Национальный научный центр «Институт экспериментальной и клинической ветеринарной медицины»
г. Харьков, ул. Пушкинская 83, 61023 Украина |
|